Le principe du dosage par paire d'ions
Fondamental :
Les paires d'ions sont des associations coulombienne entre deux ions de charges opposées. Les charges électriques impliquent que la constante diélectrique du solvant ε0, la distance entre les ions, la température auront une influence sur l'appariement d'ions.
En effet, les forces diélectriques qui maintiennent la cohésion de la paire d'ions (AB) sont données par la loi de coulomb :
On exprimera la notion de paire d'ions par des parenthèses, ex : (A-B+)
C'est Debye, Hûckel et Onsager qui ont démontré que les solutions ioniques diluées étaient complétement dissociées.Ce n'est que plus tard que les associations ioniques appelées paires d'ions ont pu être mises en évidence dans les solutions aqueuses plus concentrées grâce aux rayons X et la spectroscopie Raman
L'existence des paires d'ions est peu probable dans les solvants de constante diélectrique élevée, donc très dissociants comme l'eau.
Ceci est renforcé par le fait que les électrolytes simples ne forment des paires d'ions dans l'eau de façon significative qu'à des concentrations supérieures à 1M. Corrélativement, l'existence de la paire d'ions est favorisée dans les solvants organiques, donc de faible ε0 et lorsque l'on augmente la teneur en solvant organique des mélanges hydroorganiques (méthanol, acétonitrile...) dans les éluants pour chromatographie liquide par exemple.
Ces associations pseudomoléculaires existent surtout dans des solvants peu dissociants et s'y comportent thermodynamiquement comme des molécules neutres. Dans l'eau, solvant dissociant, elles ne peuvent pratiquement pas exister, les ions sont isolés ; toutefois il y a toujours un équilibre entre les ions libres et les paires d'ions :
Dans l'eau (ε0 = 78), le Kd est très élevé et la forme paire d'ions (lorsqu'elle est soluble dans un tel milieu) est pratiquement négligeable. Dans le cas où A- et B+ sont des espèces ioniques volumineuses, de masse relativement élévée (> 150 daltons) et suffisamment hydrophobes, il est alors possible d'extraire la paire d'ions par un solvant organique.
Dans ce cas, la taille, la structure du (ou des) ions associé(s), sont telles qu'il n'y a pratiquement pas de possibilité de couche d'hydratation à la périphérie donc de dissociation.
Plus volumineux et hydrophobes seront les ions, plus facile sera leur extraction en phase organique puisqu'ils seront moins solvatés par les molécules d'eau et auront d'avantage tendance à se solvater avec le solvant organique.
application à l'analyse
l'extraction d'un cation ou d'un anion sous forme de paire d'ions avec un ion antagoniste coloré est utilisable à des fins analytiques, à deux conditions
- que le colorant lui même à l'état moléculaire et même à l'état ionisé, ne soit pas extractible dans le solvant.
- que l'extraction de la paire d'ions soit quantitative.
Ceci n'est possible que par l'utilisation d'un excès de colorant. L'excès n'ayant pas réagi dans la formation de paire d'ions doit être insoluble en phase organique au pH de travail.
Dans le cadre pharmaecutique ce sont le plus souvent des amines ou des ammoniums quaternaires (alcaloïdes, sels halogénés d'amine) qui sont extraits à l'aide d'anions provenant de colorants acides. Aussi il est nécessaire de bien connaître le pKc de l'acide donnant l'anion coloré (A-) et le pKb de la base donnant le cation (B+).
Méthode :
Ainsi dans notre cas et en ce qui concerne les travaux pratiques, nous utiliserons un indicateur mixte et un tampon acide à pH 2,8.
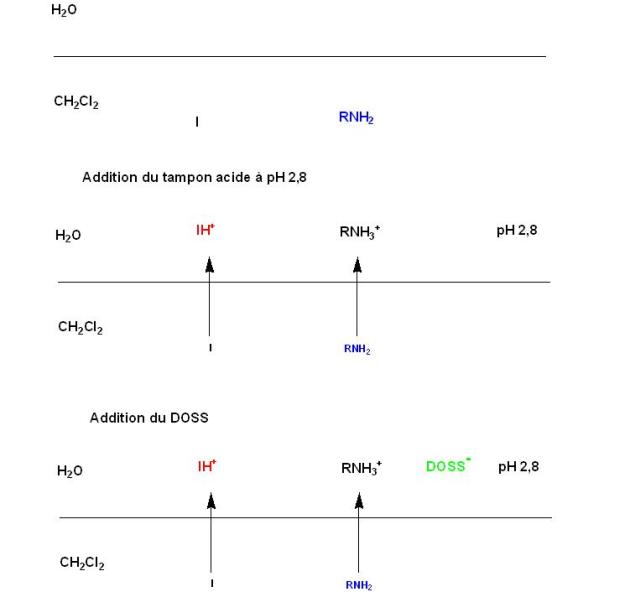
Le protocole générale sera le suivant :
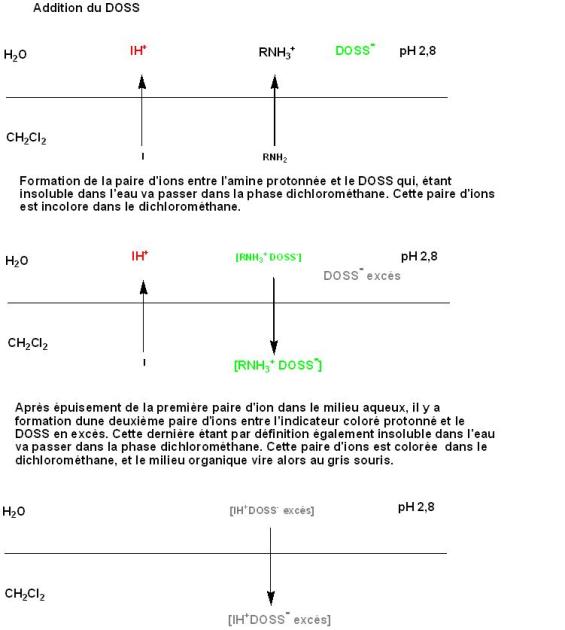
L'amine dans le comprimé est directement dosée, sans extraction préalable, par formation d'une paire d'ions avec le DOSS. En présence d'un tampon pH 2,8, l'amine est sous forme de sel soluble dans la phase aqueuse ; Par addition d'une solution de DOSS, il se forme un composé entre l'amine et le DOSS (paire d'ions la plus stable à ce pH) insoluble en phase aqueuse qui passe dans la phase organique chloroformique. Au terme du dosage, quand toute la codéine s'est appariée, un excès de DOSS se combine à l'indicateur (paire d'ions moins stable) qui vire du vert au gris sale et enfin au mauve (couleur du virage).
le principe de ce dosage peut être schématisé comme suit :