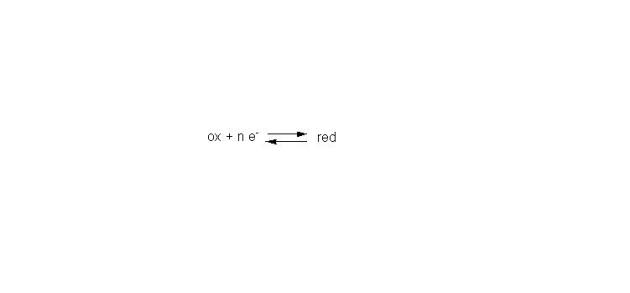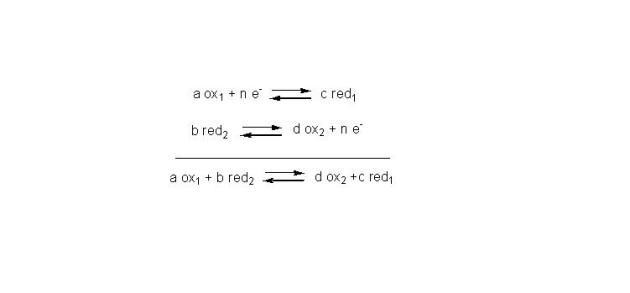Principe de l'oxydo-réductimétrie
Rappel : Degré d'oxydation
Un élément a le degré d'oxydation (ou le nombre d'oxydation) :
n+ s'il a perdu n électrons
n- s'il a fixé n électrons
Définition :
Définition : oxydation-réduction
1) l'oxydation est une perte d'électron(s) : le degré d'oxydation de l'élément augmente ; la substance qui perd des électrons est appelée réducteur
exemple : le fer ferreux Fe2+ est oxydé en fer ferrique Fe3+ avec perte d'un électron.
Fe2+-e-→ Fe3+
2) la réduction est un gain d'éléctron(s) : le degré d'oxydation de l'élément diminue ; la substance qui gagne des électrons est appelée oxydant
exemple : le passage du mercure mercurique Hg2+ en mercure mercureux Hg+ correspondant à une réduction (gain d'un électron)
Hg2++e-→Hg+
Ainsi de façon générale la relation qui définit les oxydants et les réducteurs est la suivante :
Fondamental : couple oxydo-réducteur
L'oxydo-réduction fait donc appel à une notion de couple d'oxydo-réduction ou couple oxydo-réducteur.
Pour qu'un oxydant puisse fixer un ou plusieurs électrons, il faut la présence d'un réducteur susceptible de les lui céder. L'échange d'électrons s'effectue entre deux couples oxydo-réducteurs, dont l'un s'oxyde tandis que l'autre se réduit. On ne saurait concevoir d'oxydation sans réduction simultanée et inversement.
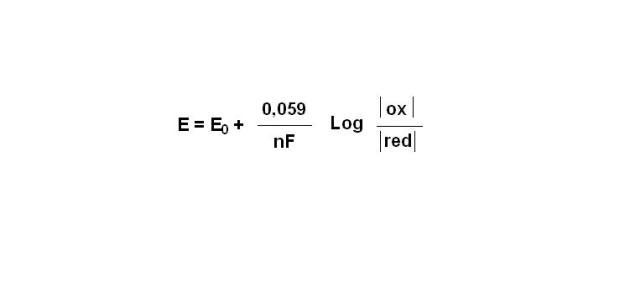
Fondamental : potentiel d'oxydo-réduction
application à l'analyse
la mesure de la différence de potentiel entre deux électrodes, l'une étant indicatrice et l'autre de référence au point où ont lieu les réactions d'échange d'électrons. La différence de potentiel mesurée au cours du titrage est donnée par la formule de Nernst :
avec E0 le potentiel normal du système oxydo-réducteur considéré, en passant aux logarithmes décimaux et en remplacant R et F par leurs valeurs de température de 25°C.
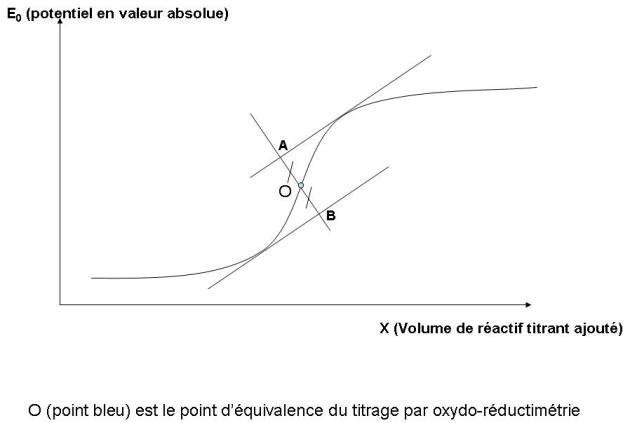
il en résulte une courbe logarithmique dont le point d'inflexion correspond au point d'équivalence de la réaction.
Ce point d'inflexion peut être déterminé graphiquement (en prenant le milieu du segment AB) et se trouve au point O.