Principe du dosage des bases organiques
Cette méthode de dosage est applicable à toutes les molécules présentant un azote basique dans leur structure (amine)
Pour exalter le caractère basique de ces molécules, la réaction est mise en œuvre dans un solvant acide.
De manière générale le solvant choisi est l'acide acétique anhydre :
- il possède un très bon pouvoir solvant
- c'est un réactif peu dangereux et de faible toxicité,
- il est peu coûteux.
Fondamental :
L'acide perchlorique dans l'acide acétique anhydre est le principal réactif titrant acide.
C'est un acide fort ; il reste suffisamment fort dans les solvants acides.
Cependant il faudra distinguer deux cas.
1) Cas des sels d'acides forts et des bases organiques :
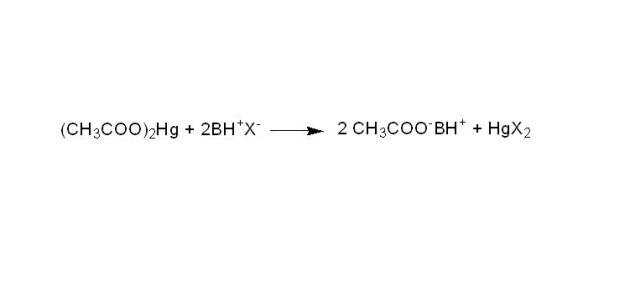
Auparavant, l'anion X-, qui possède le caractère basique, était dosé. Mais ces sels ne peuvent être dosés, généralement, par l'acide perchlorique car le caractère basique de X- n'est pas assez fort. Ceci impliquait l'utilisation d'acétate mercurique dans le milieu. Ce dernier permettait la libération d'acétate par formation du complexe non dissocié HgX2.
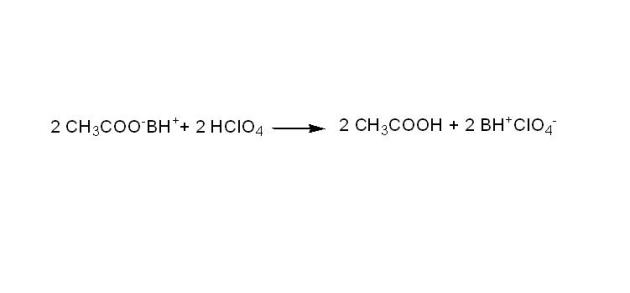
Les ions acétates, base la plus forte dans l'acide acétique, sont ensuite dosés par l'acide perchlorique. On a ainsi remplacé une base faible (X-) par une base forte (CH3COO-).
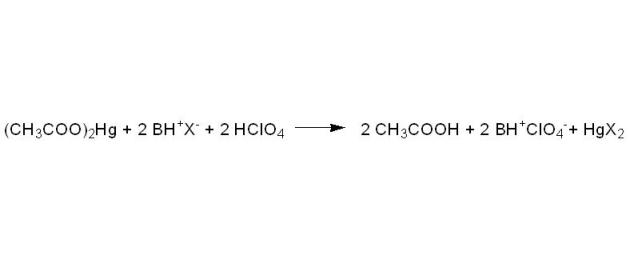
La stœchiométrie de la réaction n'est pas modifiée par la présence d'acétate mercurique : une mole de BH+X- libère une mole d'ions acétates, et consomme donc une mole d'acide perchlorique.
Soit au total :
Attention :
cette technique fut très souvent utilisée, de nombreuses bases à activité pharmacologique étant présentées sous forme de sels halogénés.
Cependant cette méthode , dite de Pifer et Wollish n'est pas spécifique de la partie organique puisqu'elle ne dose que l'anion salifiant. De plus la toxicité reconnue des sels de mercure a poussé la Pharmacopée à préconiser une autre méthode de dosage : la méthode de Billon.
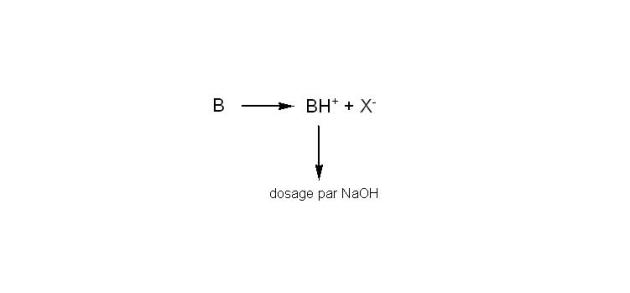
La méthode de Billon est une méthode de dosage direct qui a l'avantage d'être spécifique de la partie organique des sels halogénés de bases organiques ; car elle permet de doser la base protonnée (BH+), qui est en fait l'acide conjugué et non plus l'anion acétate libéré.
On opère alors dans l'éthanol, où les bases protonnées BH+ sont des acides assez forts pour être dosés par l'hydroxyde de sodium. la détection potentiométrique permet de mettre en évidence le point d'équivalence. Le volume d'hydroxyde de sodium permet de calculer le titre en BH+ et, donc, en base correspondante.
2) Cas des sels d'acide sulfurique et des bases organiques
Comme dans le cas précédent, la base organique est sous la forme de son acide associé (RNH3 +). La partie minérale qui possède le caractère basique est substituée par les ions acétates de l'acide acétique.
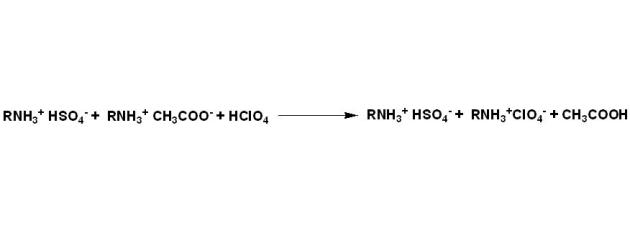
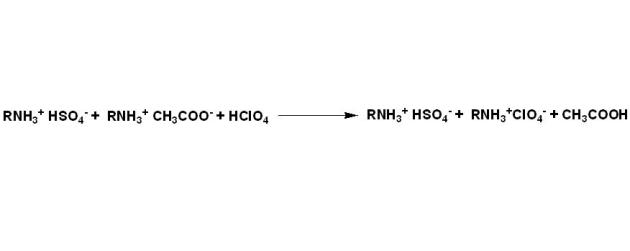
Par exemple dans le cas de sels sous forme de sulfates, où les hydroxydes d'ammonium sont des bases fortes qui peuvent être dosées directement, on pourra écrire :
Les ions acétates, bases plus fortes dans l'acide acétique, sont ensuite dosés par l'acide perchlorique.
Au final le bilan de la réaction peut s'écrire comme suit :
Remarque :
Dans l'acide acétique, l'anion HSO4 - a un caractère trop acide pour être dosés par l'acide perchlorique.