Principe du dosage par spectrophotométrie
Fondamental :
Principe : La théorie quantique définit l'énergie totale d'une molécule comme la somme de trois énergies :
- énergie électronique : Ee
- énergie de vibration : Ev Et = Ee + Ev + Er
- énergie de rotation : Er
L'absorption U.V. dépend essentiellement de Ee. La région du spectre électromagnétique concernée s'étend de 10 à 380 nanomètres. En réalité, les appareils classiques explorent la région située entre 200 et 380nm, car en dessous de 180nm, le rayonnement est absorbé par l'air et il faut opérer dans le vide.
Application :
• Qualitative : utile pour l'identification (par rapport à un témoin) ; toutefois, l'absorption UV/Visible est une technique insuffisante pour identifier à elle seule une substance, mais peut parfois compléter utilement l'infrarouge, la spectrométrie de masse, la RMN et d'autres méthodes spectrales.
• Quantitative : utile pour un dosage ; c'est une méthode rapide et précise, basée sur l'exploitation de la relation de Beer - Lambert qui relie l'absorption à la concentration des molécules en solution, pour une longueur d'onde λ donnée.
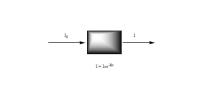
Loi de Beer - Lambert :
Io : intensité du faisceau incident à la longueur d'onde λ
I : intensité du faisceau émergent à la longueur d'onde λ
Lorsqu'un faisceau de lumière de longueur d'onde définie traverse une solution à analyser, l'intensité lumineuse absorbée par la solution est proportionnelle à la concentration de la substance absorbante.
La notion de transmission (T) est parfois utilisée : T = I /Io x 100
Pour plus de commodité, on définit la notion d'absorbance : A = 1/T soit A = εlc
l : épaisseur de la cuve (1cm)
c : concentration de la solution
: coefficient d'extinction : peut prendre plusieurs noms en fonction de l'expression de l'unité de c :
coefficient d'extinction molaire si c est exprimé en mole/l
E1% (ou A1 1): coefficient d'extinction spécifique. On obtient l'absorbance spécifique : absorbance qu'aurait une solution de produit de concentration 1% (1g/100ml) examinée sous une épaisseur de 1cm à une longueur d'onde donnée.
Conditions de validité : la loi de Beer-Lambert est valable pour :
- une lumière monochromatique (λ donnée).
- une concentration faible sinon A =f(c) n'est plus respectée.
- une solution limpide.
- des molécules stables en solution et sous l'effet de l'irradiation.
Technique :
En règle générale, il faut faire le dosage du produit à analyser par rapport à une gamme étalon d'un témoin : pour ce faire on prépare une solution mère S d'étalon puis 3 dilutions (S1, S2, S3) à partir de la solution mère S. La solution mère est préparée dans une fiole jaugée, en pesant la quantité exacte de produit, en dissolvant dans un minimum de solvant et en complétant par le même solvant ; les différentes dilutions de S sont réalisées par prélèvement à la pipette de précision (rincée au préalable par la solution S) puis en complétant les fioles jaugées « filles » par le même solvant.