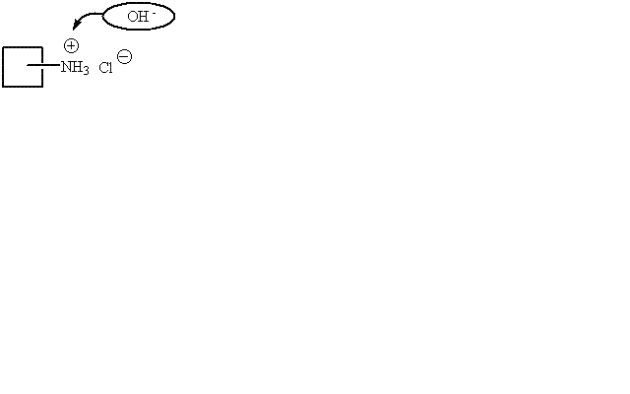Cas des sels d'acides forts halogénés et des sels d'acide sulfurique
Cas des sels d'acides forts halogénés et des bases organiques
• Principe : L'anion X- n'a pas un caractère basique assez fort pour être dosé directement par l'acide perchlorique. L'addition au milieu d'acétate mercurique en solution dans l'acide acétique anhydre (RG1) en excès libère quantitativement des ions acétates (CH3COO-) par formation du complexe non dissocié (HgX2) ; Ces ions acétates, bases les plus fortes dans l'acide acétique, sont ensuite dosés par l'acide perchlorique.
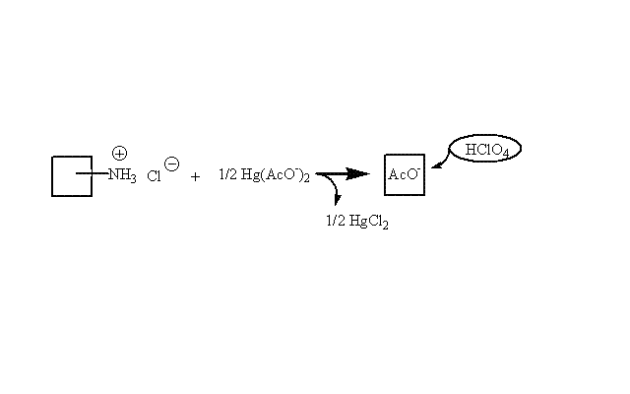
Cette méthode n'est cependant pas spécifique de la partie organique puisqu'elle ne dose que l'anion salifiant. Compte-tenu de la toxicité des sels de mercure, la Pharmacopée préconise maintenant une autre méthode.
Elle présente l'avantage d'être spécifique de la partie organique, car c'est la base protonée BH+ (c'est à dire l'acide conjugué) qui est titrée. On opère dans l'éthanol, car, dans ce solvant, la majorité des bases protonées sont des acides assez forts pour être dosés par l'hydroxyde de sodium. La détection potentiométrique permet de mettre en évidence le point d'équivalence. Le volume d'hydroxyde de sodium permet de calculer le titre en BH+ et donc en base correspondante.
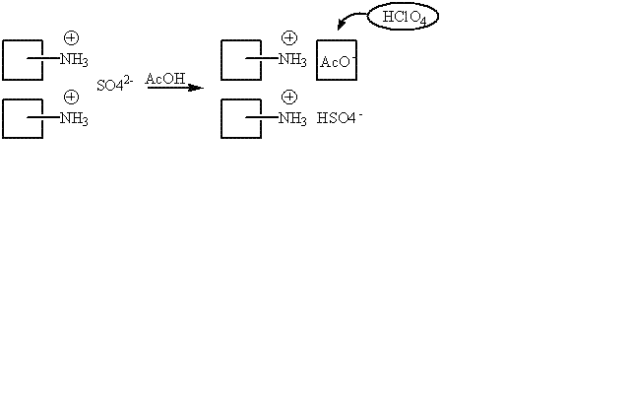
cas des sels d'acide sulfurique et de bases organiques
comme dans les cas précédents, la base organique est sous la forme de son acide associé (RNH3 + ). La partie minérale qui possède le caractère basique est substituée, dans l'acide acétique, en ions acétates. Ce sont ces ions acétates, bases plus fortes dans l'acide acétique, qui sont ensuite dosés par l'acide perchlorique. Dans l'acide acétique, l'anion HSO4 - a un caractère trop acide pour être dosé par l'acide perchlorique : on n'observe pas la réaction de substitution ; autrement dit, l'équivalent correspondant au poids moléculaire du sel. Le dosage n'est pas spécifique de la molécule organique.
Méthode : Caractérisation des lots
En fonction de la nature du sel rencontré, les méthodes de caractérisation vont être différentes.
Caractérisation d'halogénures :
• Technique : dans un tube à essai, acidifier une solution aqueuse du produit à analyser (quelques mg dans 2ml d'eau distillée) par quelques gouttes d'acide nitrique (R 9) et y ajouter quelques gouttes de nitrate d'argent (R 10). Il se développe un précipité blanc d'halogénure d'argent (AgX).
Caractérisation des sulfates :
• Technique : dans un tube à essai, acidifier une solution aqueuse du produit à analyser (quelques mg dans 2ml d'eau distillée) par quelques gouttes d'HCl concentré (R.4) jusqu'à pH acide et y ajouter quelques gouttes de solution de chlorure de baryum (R.5). Il se produit un précipité blanc de sulfate de baryum (ou un trouble).