Données sur l'acide ascorbique
L'acide ascorbique est la vitamine C. C'est un antioxydant très utilisé dans l'industrie alimentaire. Auparavant elle était indiquée dans les cas de scorbut.
Données physico-chimiques :
Nombre CAS : 50-81-7
C6H8O6
Masse Moléculaire : 176.12 g.mol-1
Crystaux (habituellement plats, parfois aiguilles). mp 190-192°. densité 1.65. [α]D25 = +20.5 à +21.5° (c = 1 dans l'eau); potentiel redox : E0= +0.166 V (pH 4). Un gramme dissout dans environ 3 ml d'eau, 30 ml d'alcool, 50 ml d'alcool absolu, 100 ml de glycerol, 20 ml de propylène glycol. Solubilité dans l'eau 80.0 % dans l'eau à 100°C, 40.0% à 45°C. Insoluble dans l'éther, le chloroforme, le benzène, l'éther de pétrole, l'huile, les graisses et les solvants gras. Agent réducteur fort. Stable à l'air quand il est sec. En solution aqueuse, il est rapidement oxydé par l'air.
pKa: pK1 = 4.17; pK2 = 11.57
Absorption maximum: uv max à pH 2: 245 nm (E1%(1cm) = 695); à pH 6.4: 265 nm (E1%(1cm) = 940)
Optical Rotation: [α]D25 = +20.5 à+21.5° (c = 1 dans l'eau); [α]D23 =+48° (c = 1 dans le MeOH)
Complément : Synthèse de l'acide ascorbique
L'étude de la synthèse de l'acide ascorbique permet :
-la compréhension de la synthèse que l'on retrouve en industrie
-la compréhension de la recherche d'impuretés spécifiques liées à la synthèse durant le contrôle du médicament.
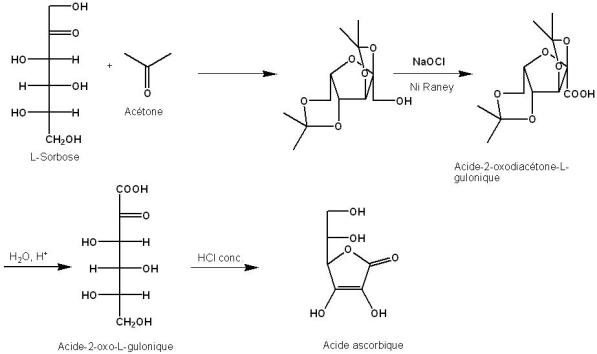
La synthèse de l'acide ascorbique démarre avec le L-sorbose, provenant de la réduction et de la transformation par un micro-organisme du D-glucose. Par la suite, par réaction avec l'acétone, donne le L-sorbose diprotégé. Une oxydation formelle aboutie à l'acide correspondant, qui est déprotégé en milieu acide. Un traitement à l'acide chlorhydrique concentré permet la cyclisation et l'obtention de l'acide ascorbique.
Attention :
attention à l'oxydation à l'air libre ou en solution. Ne pas laisser les solutions longtemps (1h) sur la paillasse avant les analyses.
l'étudiant par le biais de cette adresse peut aller sur le site de la pharmacopée européenne pour la consulter :





